LA FARMACOVIGILANZA NEGLI STUDI CLINICI
Che cos'è la farmacovigilanza?
La Farmacovigilanza è definita dall’AIFA come “il complesso di attività finalizzate a valutare in maniera continuativa tutte le informazioni relative alla sicurezza dei farmaci e ad assicurare, per tutti i medicinali in commercio, un rapporto beneficio/rischio favorevole per la popolazione”.
A che cosa serve la farmacovigilanza?
Grazie alla Farmacovigilanza, lo Sperimentatore o il Promotore di uno Studio Clinico:
- Individua efficacemente le reazioni avverse causate dal farmaco in sperimentazione;
- Ottiene nuove informazioni sulle reazioni avverse sospette o già note;
- Identifica i fattori di rischio che determinano la comparsa di sospette reazioni avverse in relazione ai parametri rilevanti per la sperimentazione;
- Confronta i profili di sicurezza dei farmaci all’interno di una categoria terapeutica, così da valutare i vantaggi di un farmaco rispetto ad altri trattamenti disponibili per la medesima patologia;
- Comunica le informazioni di sicurezza a tutti gli operatori sanitari per migliorare la pratica clinica.
Che cosa comporta la farmacovigilanza per il Promotore di una sperimentazione?
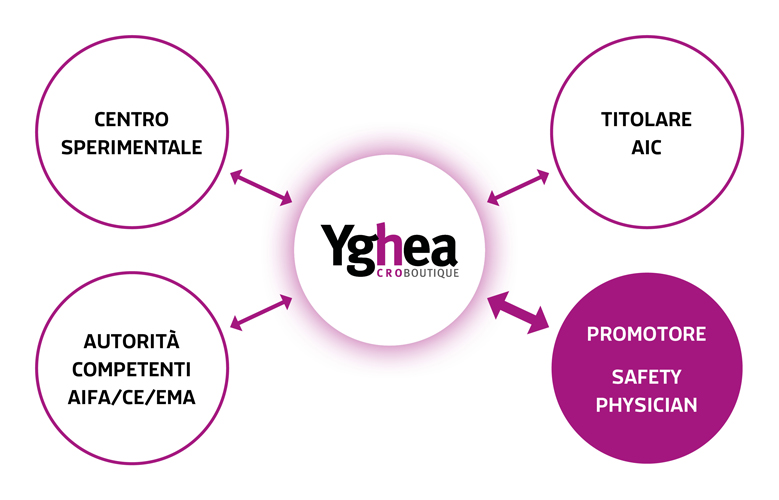
Per meglio comprendere a quali attività debba adempiere il Promotore dello studio clinico, è utile pensare alla Farmacovigilanza come un “ecosistema” di soggetti in relazione gli uni con gli altri.
L’ecosistema della farmacovigilanza
Il Promotore è al centro di questo “ecosistema”.
Affinché la sperimentazione sia condotta in conformità e sicurezza, deve:
- Essere registrato all’interno della piattaforma EudraVigilance;
- Disporre per tutta la durata dello studio di un utente certificato e abilitato per l’inserimento dei dati di farmacovigilanza all’interno del Clinical Trial Module della piattaforma (EVCTM);
- Mantenere un aggiornamento costante delle informazioni di sicurezza relative alla sicurezza del prodotto medicinale su cui sta svolgendo sperimentazione;
- Effettuare una valutazione medica dei casi e di tutte le informazioni di Safety che si generano nel periodo dello studio;
- Mantenere archiviazione e aggiornamento di tutta la documentazione di funzione generata durante lo studio in formato sia elettronico sia cartaceo;
- Avere accesso al dizionario MedDra per la codifica degli eventi da inserire all’interno delle piattaforme in forma idonea.
Nei confronti del Centro Sperimentale, il Promotore deve:
- Preparare il modulo di segnalazione degli eventi segnalabili, cioè quelli seri e le reazioni avverse, i SUSAR (Suspected Unexpected Serious Adverse Reaction) ovvero gli eventi avversi seri potenzialmente correlati e inattesi, e gli eventi avversi di speciale interesse.
- Disporre informazioni per il personale del centro sperimentale e mantenere un training costante per essi, anche in caso di handover, per tutta la durata dello studio.
- Essere reperibile 24h 365 giorni all’anno per poter rispettare le tempistiche imposte dalla normativa per la segnalazione degli eventi avversi e di interesse seri.
- Fornire supporto al Centro Sperimentale per la segnalazione, avere rapporti diretti e costanti col personale del Centro per la raccolta di tutte le informazioni utili all’analisi dei casi dal punto di vista della farmacovigilanza.
- Fornire aggiornamento costante sui dati di sicurezza disponibili inclusi i report dei SUSAR eventualmente intercettati da altri centri sperimentali partecipanti allo studio.
Rispetto al Titolare AIC, cioè il responsabile della commercializzazione del farmaco, il Promotore deve:
- A inizio studio, definire il cosiddetto SDEA (Safety Data Exchange Agreements): un accordo di scambio dei dati di sicurezza. In questo documento si definiscono le tipologie di informazioni da trasmettere, la periodicità e il formato con cui devono essere scambiate.
- In linea con quanto stabilito nello SDEA, è necessario che il Promotore, periodicamente, crei e trasmetta gli stati di eventi o report di casi singoli al Titolare AIC, che conserva la responsabilità della sorveglianza costante e della sicurezza del suo farmaco anche quando utilizzato all’interno di sperimentazioni cliniche di parti terze.
Il Promotore deve mantenere un rapporto costante anche con le Autorità Competenti (AIFA, i Comitati Etici ed EMA, l’Agenzia europea dei medicinali):
- Crea e notifica i CIOMS per gli eventi che lo richiedono;
- Notifica i SUSAR sia in fase iniziale sia in follow-up per tutta la durata dell’evento, tramite l’apposito modulo su EudraVigilance;
- Crea e inoltra il cosiddetto DSUR, cioè un rapporto periodico che comprende tutti i dati relativi alla sicurezza, sia quelli generati nell’ambito dello studio sia quelli rilevanti e presenti in letteratura o pubblicati dalla comunità scientifica rispetto al prodotto medicinale in sperimentazione nell’anno di riferimento. Il DSUR, infatti, è periodico e deve essere inviato una volta all’anno a partire dalla data di prima autorizzazione dello studio fino alla sua conclusione.
Che cosa può fare Yghea per il Promotore di una sperimentazione?
Yghea può sostituirsi al Promotore per tutti gli aspetti relazionali, mantenendo ovviamente una forte collaborazione con esso per il trasferimento delle informazioni utili e permettendogli di rimanere focalizzato sugli aspetti per esso fondamentali, cioè la valutazione medica dei casi e delle informazioni. Qualora il Promotore non fosse ancora registrato in EudraVigilance, Yghea può supportarlo in tutte le fasi della registrazione.
Lavorare con Yghea sulla Farmacovigilanza consente al Promotore della sperimentazione di:
- Focalizzarsi esclusivamente sulle attività ad alto contenuto scientifico e, in particolare, la valutazione medica dei casi, liberandosi dall’onere di adempiere a tutte le incombenze appena descritte;
- Essere pienamente e costantemente conforme a tutti i requisiti normativi;
- Avere a disposizione un supporto operativo costante e informazioni strategiche;
- Acquisire competenze specialistiche;
- Ottimizzare le risorse, sia in termini di personale sia economiche, a disposizione.
Ogni soluzione deve essere taylor made, cioè accuratamente calibrata e ponderata sulle caratteristiche specifiche del progetto: contattaci per scoprire come gestire con successo, insieme a noi, tutti gli aspetti di safety relativi al tuo studio. Liberi e sicuri di sperimentare con Yghea!

